纯净的金刚石是无色透明、正八面体形状的固体;石墨是一种深灰色有金属光泽而不透明的细鳞片状固体。石墨很软,在纸上画过可留下痕迹,有滑腻感。金刚石和石墨“形”或“性”有着天壤之别,但它们具有相同的“质”,它们是一对“孪生”兄弟,都由碳元素组成,被称为“同素异构体”。

金刚石和石墨这对孪生兄弟,个性完全不同。石墨外表黝黑,质地软得一折就断。相反,金刚石外表光泽灿烂夺目,是世界上最硬的物质。金刚石可以用来切割玻璃、做钻头,因为它的硬度很大;石墨可以用来做铅笔芯、润滑剂,这是因为它很软、有滑腻感。按照莫氏硬度标准,金刚石为最高级。
为什么金刚石和石墨的差异如此大?
原因就在于它们自身的结构不一样。在石墨和金刚石中,碳原子的结合方式及排列方式各不相同。在化学世界里,一种元素若拥有几种不同的晶体结构,这种现象就称为“同素异构”,正因晶体结构不同,其物理性质或化学性质也会有所不同,比如会具有不同的颜色、密度、硬度、溶解度,以及在化学反应上表现不同的本领等。
石墨的结构呈层状排列,像千层糕一样,一层层迭加起来,就一个片层而言,碳以六边形连结成平面网,每1个碳原子会与其周围的3个碳原子通过强烈的相互作用紧密结合,“紧密结合”的两个碳原子之间的距离约为0.142nm(即六边形的每边之长)。碳原子和碳原子间的结合力,是靠相互贡献来的电子(共用电子)对所形成的。共用电子对把两个碳原子结合的很牢固,我们把这共用电子对所形成的束缚力称为“共价键”。
而各个平行层与层之间的距离为0.335nm,几乎两倍于每平面层中两个碳原子间的距离,正因如此,层与层之间的结合力较弱。而层与层之间的结合力,是由各碳原子提供一个电子在每一平面层上自由移动所形成的,这些运动的电子并没有把碳原子连结得很牢固,容易散开来,故这种结合力又称为“金属键”。因此很容易沿着与层面平行的方向滑动、裂解,所以石墨很软、有滑腻感。
也由于电子可以在层与层之间自由移动,所以石墨可以导电。因此,石墨本身结构的最大特点,就是由牢固的共价键和不牢固的金属键之双重键型所组成的。如此一来,使得石墨的层与层之间容易滑动,甚至断开,而使石墨的质地变得很柔软。但是,由于同一平面层上的碳原子间结合力很强(共价键之故),极难破坏,所以石墨的熔点较金刚石高,且化学性质也较稳定。石墨的晶体结构也决定着它的物理特性。
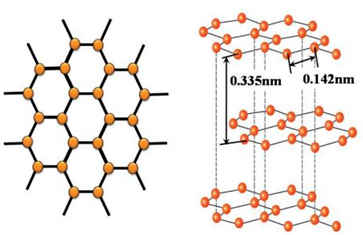
石墨的结构模型
对于一个单晶体而言,石墨可看作是一个二维的金属。也就是说,石墨晶体中由于有两种不同的结合力,使得其晶体层的平行方向和垂直方向的导电性及导热性产生了差异,这种现象称之为“各向异性”。根据研究指出,其两个方向性能的数值比为3:1~4:1。但由于一般石墨的晶体分布甚为杂乱,因而整体来看,就显不出很大的方向性。
金刚石就不一样了。每个金刚石的晶胞(构成金刚石的最小单位,犹如生物组织的细胞)中有四个碳原子,各个碳原子分布在正四面体的四个顶角上,且碳原子和碳原子之间是以牢固的共价键相连接。许许多多这样大小、形状相同的晶胞,有规则地紧密连接在一起。且在金刚石晶体中,每个碳原子与它邻近的四个共价碳原子通过强烈的相互作用紧密结合。“紧密结合”的两个碳原子之间的距离约为0.155nm,从而形成致密的三维结构。这样排列的碳原子具有很高的结合能,因为各碳原子间的距离相等,使得金刚石晶体具有无隙可乘的结构,拥有最高的力学强度,因而使得金刚石成为天然存在的最坚硬的物质。
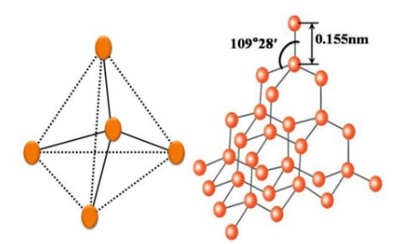
金刚石的结构模型
此外,金刚石和石墨相比,结构更为致密。金刚石的密度大约是石墨的1.5倍左右(金刚石的密度约为3.5-3.53g/cm³,石墨的密度约为2.09–2.23g/cm³),可见碳原子在金刚石里要比在石墨中密实许多。从上述介绍中,我们可以清楚地了解到,物质的硬度取决于他们原子之间的键结方向和键能强度。
相对于石墨的导电性,金刚石不导电是因为金刚石中每个碳原子与其周围的4个碳原子通过“共用电子对”形成强烈的相互作用,碳原子最外层的4个电子几乎都参与了这种“力”的形成,基本没有自由电子,所以基本不导电。
前面所述石墨的熔点较金刚石高,但是二者的沸点却相同,这又是为什么呢?物质的物态变化与微粒间的距离是有一定关系的。石墨和金刚石熔化以后,碳原子原来的排列方式被打破,原子间的距离相等,相互作用强度也相同,所以沸点相同。
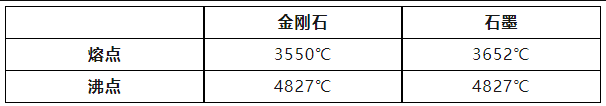
所以,透过现象看本质,结构决定性质,金刚石和石墨都由碳原子构成,但因为原子排列方式不同,导致很多物理性质有很大差异。


 手机资讯
手机资讯 官方微信
官方微信










 豫公网安备41019702003645号
豫公网安备41019702003645号